ПРОБЛЕМНІ СТАТТІ
УДК 615.322:454.1:615.415.6
В.В. Шаповалов, к.ф.н., В.А. Шаповалова, д.ф.н., Н.М. Халін, Т.В. Кузнецова, А.И. Гризодуб
КВАЛИФИЦИРОВАНИЕ РЕЖИМА КОНТРОЛЯ И СУДЕБНО-ФАРМАЦЕВТИЧЕСКОГО СКРИНИНГА ДИАГНОСТИЧЕСКОГО СРЕДСТВА
Кафедра судебной фармации Национального фармацевтического университета, г. Харьков,
УБОП УМВД Украины в Харьковской области
В медицинской практике с диагностической целью в настоящее время находят применение как традиционные лекарственные средства (ЛС) — радиофармацевтические и иммунологические препараты (диагностикумы), так и некоторые химические вещества — красители, разрешенные к медицинскому применению. К традиционным ЛС — диагностикумам относятся, например, гистамин, используемый для определения секреторной способности желудка, трокафен с гистамином — для диагностики феохромоцитомы, цититон — для определения скорости кровообращения при шоковых состояниях, при угнетении дыхания и кровообращения у больных инфекционными заболеваниями, натрия бензоат — для исследования антитоксической функции печени.
Широкое применение в качестве диагностических средств имеют радиофармацевтические препараты — вещества, меченые радиоактивными изотопами. В настоящее время также разработаны и применяются иммунологические препараты-диагностикумы.
Диагностические препараты последних групп имеют специфические области применения и назначаются по специальным схемам. Среди рентгеноконтрастных средств применяются производные трийодбензойной кислоты (например, триомбраст, йодамид); адипиновой кислоты (например, билигност); ундекановой кислоты (например, этиотраст) и другие [5, 6]. Следует указать, что с позиций судебно-фармацевтического критерия трипептиды (например, рифатироин), пентапептиды (например, пентагастрин), производные янтарной и лимонной кислот (например, лимонтар), производные трийодфенилпропионовой кислоты (например, кислота йопаноевая, билимин) и некоторые другие рентгеноконстрастные средства относятся к сильнодействующим веществам (СВ).
К СВ относятся также и нетрадиционные ЛС, химические вещества — красители, разрешенные к медицинскому применению. Среди последних можно назвать индигокармин, используемый для диагностики функции почек; флюоресцен-натрий — для функционального исследования сердечно-сосудистой системы, выделительной функции почек и функции печени [6].
Как известно, классификационно-правовая группа СВ включает в себя: субстанции для производства ЛС; сильнодействующие ЛС, товары бытовой химии; биологически-активные вещества (БАВ), получаемые в процессе синтеза; растительное сырье; вещества химического производства; препараты ветеринарии; вещества, используемые в сельском хозяйстве и др. [21].
Систематизированный нами ранее режим контроля СВ регулируется приказами МЗ Украины: №233 от 25.07.97 г., №117 от 30.06.94 г., №172 от 20.09.95 г. [23]. Уголовно-правовое регулирование незаконного оборота СВ базируется на принципах Уголовного кодекса (УК) Украины в соответствии со статьей 321 (ранее 229) [7, 13, 15, 20, 22].
В настоящее время продолжает оставаться актуальным менеджмент, маркетинг и упорядочение контрольно-разрешительной системы оборота синтезируемых новых БАВ по номенклатурно-правовому признаку с целью избежания возможных правонарушений со стороны фармацевтов, провизоров, химиков и других специалистов, занимающихся фармацевтической деятельностью в области оборота ЛС [10]. Указанные исследования по упорядочению классификации БА проводятся на различных этапах оборота СВ, включающих их производство, использование, хранение, учет, стандартизацию, контроль качества, уничтожение и др.
Квалифицирование режима контроля синтезируемых БАВ будет способствовать тому, что в ходе исследуемых судебной химико-фармацевтической экспертизой (СХФЭ) средств и веществ, последние необходимо также классифицировать и по уголовно-правовому признаку [7, 22, 24, 26].
В этих условиях возрастает роль и значение судебно-фармацевтического скрининга (СФС). СФС представляет собой совокупность используемых в СХФЭ организационных, законодательных и нормативно-правовых подходов, состоящих из набора специально подобранных методов, которые применяются при исследовании различных классификационно-правовых групп средств и веществ. В настоящее время в ходе проводимых исследований синтезировано новое диагностическое средство, относящееся к группе азокрасителей и представляющее собой по химическому строению производное азобензола — 2,4-диамино-4' — этоксиазобензол (соединение 1):
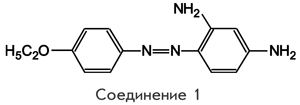
Соединение 1 в доступных зарубежных фармакопеях последних лет не описано [27, 28]. Аналог соединения 1 в виде таблеток описан в справочнике "Лекарственные средства" [5] и представляет собой диагностическое средство — таблетки ацидотеста 0,05 г, производства фирмы "Хиноин", Венгрия. Соединение 1 относится к диагностическим средствам, разработанным для определения кислотности желудочного сока в тех случаях, когда затруднено введение пациенту желудочного зонда. Диагностические свойства указанного соединения заключаются в его способности в кислом содержимом желудка (рН среды менее 3) быстро высвобождаться из таблетки, всасываться в кишечнике и выводиться с мочой. При меньшей кислотности желудочного сока высвобождение соединения 1 происходит медленно.
Таким образом, степень высвобождения соединения 1 в желудке влияет на интенсивность окрашивания мочи пациента, по которой определяется уровень кислотности тестируемого организма (нормальный, повышенный или пониженный).
Целью нашей работы явилось квалифицирование режима контроля и проведение СФС по разработке методики количественного определения нового БАВ — производного азобензола, относящегося к диагностическим средствам.
Материалы и методы исследования
Для достижения поставленной цели нами исследован спектрофотометрический метод стандартов (СМС), отличающийся достаточной аналитической точностью и воспроизводимостью результатов [2]. В качестве объекта исследования выбрано новое БАВ — соединение 1, которое изучалось в лекарственной форме в виде таблеток. В основу разработки методики количественного определения соединения 1 положено свойство, характерное для азокрасителей и заключающееся в их способности изменять свою окраску в зависимости от рН среды [9]. Изменение окраски соединения 1 в кислой среде связано с образованием катиона индикатора за счет наличия в молекуле азогруппы, которая имеет неподеленную пару электронов и способна присоединять протоны [9]:
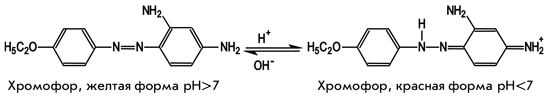
В зависимости от рН среды соединение 1 изменяет окраску от желтой (рН около 9) до красной (рН менее 2). Соединение 1 обладает свойством поглощать в этих средах в видимой области спектра благодаря наличию в своей структуре бензольного кольца. Для изучения спектральных характеристик соединения 1 были сняты его спектры в кислой и щелочной средах, а также исследована стабильность полученных растворов.
Результаты исследования спектров поглощения соединения 1 в 0,1 М растворе кислоты хлористоводородной с рН 2 (1) и в боратном буферном растворе с рН 8 (2) приведены на рис. 1. Как видно из рис. 1, спектр поглощения соединения 1 в 0,1 М растворе кислоты хлористоводородной с рН 2 (1) имеет максимум поглощения при длине волны 479±2 нм и обладает высокой предельной чувствительностью поглощения — 0,5 мкг/мл. Спектр поглощения соединения 1 в боратном буферном растворе с рН 8 (2) имеет максимум поглощения при длине волны 443±2 нм и плечо при длинах волн от 402 до 405 нм, при этом предельная чувствительность поглощения составляет 0,5—1 мкг/мл.
Таким образом, способность соединения 1 к поглощению при различных значениях рН была использована нами для достижения поставленной цели и проведении СФС по разработке методики количественного анализа соединения 1 в таблетированной лекарственной форме.
В качестве оптимального растворителя был выбран боратный буферный раствор с рН 8. Спектр поглощения соединения 1 в боратном буферном растворе с рН 8 (2) имеет максимум поглощения при длине волны 443±2 нм и плечо при длинах волн от 402 до 405 нм, при этом предельная чувствительность поглощения составляет 0,5—1 мкг/мл. В качестве раствора сравнения был выбран 0,0006% раствор рабочего стандартного образца в том же растворителе, что и исследуемый раствор, и с содержанием основного вещества не менее 99,0%. Испытуемый и стандартный растворы сохраняли стабильность в течение 3 суток, что подтверждено спектральным методом путем измерения оптических плотностей в течение наблюдаемого срока (5 дней) этих растворов в максимуме поглощения при длине волны 443 нм. С целью изучения прямолинейности калибровочного графика зависимости D = f(C) была снята оптическая плотность (D) при длине волны 443 нм и при разных значениях концентраций соединения 1 (С) в буферном растворе с рН 8. Установлено, что закон Бугера-Ламберта-Бера выполняется в пределах концентраций от 0,5 до 10 мкг/мл (рис. 2).
Из рис. 2 видно, что калибровочная кривая соединения 1 в границах концентраций от 0,5 до 10 мкг/мл представляет собой прямую линию, что свидетельствует в пользу отсутствия вероятности систематической ошибки определения. В ходе экспериментального изучения было показано, что спектр поглощения соединения 1, извлеченного из таблеток, практически не отличается от спектра поглощения рабочего стандартного образца. Последнее обстоятельство свидетельствует в пользу того, что входящие в состав таблеток вспомогательные компоненты не мешают определению соединения 1 (рис. 3).
Результаты и их обсуждение
Проведенные нами исследования позволили разработать методику количественного определения соединения 1 в новом лекарственном средстве в форме таблеток. Предложенная методика заключается в следующем: 20 таблеток соединения 1 взвешивают с точностью до 0,0002 г и тщательно растирают в порошок. Около 0,06 г (точная навеска) порошка растертых таблеток помещают в мерную колбу вместимостью 100 мл, прибавляют 40 мл 95% спирта и энергично встряхивают в течение 20—30 мин, доводят объем раствора до метки буферным раствором с рН 8 и перемешивают. 25 мл полученного раствора центрифугируют при 4000 об/мин в течение 20 мин. 3 мл жидкости над осадком помещают в мерную колбу вместимостью 50 мл, доводят объем раствора буферным раствором с рН 8 до метки, перемешивают и замеряют оптическую плотность исследуемого и стандартного раствора на спектрофотометре при длине волны 443 нм в кювете с толщиной слоя 10 мм, используя в качестве раствора сравнения буферный раствор с рН 8.
Содержание соединения 1 в одной таблетке не должно превышать 0,05 г ± 7,5%.
Содержание (Х) соединения 1 в одной таблетке (в граммах) вычисляют по формуле:
X=D1•100•50•m0•m / D0‹3•200•20•50•m1=
=D1•m0•m / D0•m1•120,
где D1 — оптическая плотность испытуемого раствора;
D0 — оптическая плотность раствора рабочего стандартного образца;
m1 — масса навески препарата, г;
m — масса навески 20 таблеток, г;
m0 — масса навески рабочего стандартного образца, г.
По разработанной методике проведено количественное определение на образцах соединения 1, изготовленных в условиях фармацевтического производства. Установлено, что предлагаемая методика контроля количественного содержания соединения 1 обладает высокой чувствительностью, специфична и селективна.
Метрологические характеристики количественного определения соединения 1 в объекте исследования приведены в таблице.
Из таблицы видно, что относительная ошибка (e, %) определения соединения 1 в объекте исследования не превышает 1%, а результаты определения не отягощены систематической ошибкой (d). Отсюда следует, что разработанная методика количественного определения соединения 1 обладает не только точностью, но и высокой воспроизводимостью и достоверностью определения, что очень важно при нахождении малых количеств соединения 1 в возможных объектах исследования при проведении СХФЭ. Полученные в ходе исследований показатели: точность и воспроизводимость результатов, предел обнаружения и линейность (рис. 2), предел количественного определения (рис. 3) — квалификационные характеристики СФС, характеризующие правильность выбранного метода анализа.
Таким образом, разработанную методику целесообразно использовать не только для количественного определения соединения 1 в форме таблеток, но и в тестах "Однородность дозирования" и "Растворение", что может представлять интерес при постадийном контроле в процессе промышленного производства соединения 1. Предлагаемая методика спектрофотометрического количественного определения соединения 1, производного азобензола, также может быть использована и при назначении СХФЭ для решения квалификационных задач по объекту исследования.
Квалифицируя режим контроля соединения 1, яляющегося производным азобензола, можно прогнозировать отнесение его к группе СВ. В связи с этим законный оборот соединения 1 регулируется приказами МЗ Украины: №117 от 30.06.1994 г. и №233 от 25.07.1997 г., а незаконный оборот — статьей 229 частью 1 и частью 2 УК Украины [1, 3, 10, 20].
Выводы
1. Квалифицирован режим контроля производного азобензола, относящегося к СВ и применяющегося медицине в качестве диагностического средства.
2. Проведен судебно-фармацевтический скрининг СВ с применением одноволнового СМС.
3. Разработана унифицированная методика количественного анализа СВ в форме таблеток с использованием СМС, характеризующаяся высокой точностью, чувствительностью и воспроизводимостью результатов контроля.
4. Разработанную методику целесообразно применять не только для количественного определения исследуемого СВ в тестах "Однородность дозирования", "Растворение", а также и при проведении СХФЭ.
Литература
1. Альберт А. Избирательная токсичность. Физико-химические основы терапии. пер. с англ. —М: Медицина, 1989. —Т. 2. —400 с.
2. Берштейн И.Я., Каменский Ю.Л. Спектрофотометрический анализ в органической химии. —Л.: Химия, 1986. —200 с.
3. Вопросы диагностики лекарственных средств при проведении судебной химико-фармацевтической експеризы // В.В. Шаповалов, В.А. Шаповалова, В.И. Кабачный та ін. // Актуальные вопросы диагностики, лечения и профилактики заболеваний человека: I Международ. компьютерная конф. —Тернополь, 1994. —С. 8.
4. Государственная фармакопея. ХI издание, Москва, 1988. —С. 116—117.
5. Машковский М.Д. Лекарственные средства. —Вильнюс: Торсинг, 1993. —Т. 2, —С. 429.
6. Машковский М.Д. Лекарственные средства. —Харьков: Торсинг. —1997. —Т. 2. —С. 484—489.
7. Уголовный кодекс Украины: Научно-практический комментарий //Отв. ред.: С.С. Яценко, В.И. Шакун. —К.: Правові джерела, 1998. —С. 971—1011.
8. Фармацевтический анализ лекарственніх средств / Под общ. ред. В.А. Шаповаловой. —Харьков: ИМП "Рубикон", 1995. —400 с.
9. Черных В.П., Зименковский Б.С. Реакционная способность диазосоединений. Физические основы теории цветности. Красители. Текст лекции. —Киев: РМК по ВМО МЗ УССР, 1989. —44 с.
10. Шаповалов В.В., Губский Ю.В., Шаповалова В.А. Правовая и судебная фармация: уголовно-правовые медико-фармацевтические и социально-экономические основы конструирования новых комбинированных лекарственных средств на основе известных фармакологических субстанций // В сб.: "Дослідження сучасної фармації та перспективи розвитку у новому тисячолітті. —Харків, 1999. —С. 769.
11. Шаповалова В.А., Василенко Л.Е., Зинченко Л.И., Шаповалов В.В. и др. // Инструктивно-методические материалы по анализу некоторых сложных лекарственных форм. —Харьков, 1993. —С. 3—15.
12. Шаповалова В.О. Прописи, які часто повторюються, як резерв створення готових лікарських засобів для дітей. 3б. Тр. 1-го Конгресу СФУЛТ. —Львів, 1994. —С. 5—51.
13. Шаповалова В.А., Шаповалов В.В. Справочник по правовой и судебной фармации. —Харьков: "Торсинг, 1997. —656 с.
14. Шаповалова В.А, Кабачный В.И., Шаповалов В.В. и др. Преспективы создания новых препаратов для детей // В кн.: Чернобыль и здоровье населения. —Киев, 1995. —Т. 3. —С. 291.
15. Шаповалов В.В., Шаповалова В.А., Черных В.П. Правовая и судебная фармация // Тез. докл. V Рос. национ. конгр. "Человек и лекарство". —Москва, 1998. —С. 715.
16. Шаповалов В.В. Конструирование ноых лек. средств на основе известных фармакологических субстанций // Там же. —С. 636.
17. Шаповалова В.О. Рентгеноструктурні та термогравіметрічні дослідження в ряду гетероциклічних сполук з комплексною фармакологічною дією // Фармац. журн. —1996. —№5—6. —С. 82—86.
18. Шаповалова В.О. Проведення фрагментарно-фармакологічного аналізу та встановлення структурно-фармакоформних зв'язків у ряду похідних гетеріламідів янтарної кислоти та спорідненими групами відомих фармакологічних субстанцій // В зб. Досягнення сучасної фармації — в медичну практику. —Харків, 1996. —С. 86—87.
19. Шаповалова В.О., Черних В.П. Обгрунтування програми комплексного підходу до питання створення вітчизняних дитячих лікарських форм // Там же. —С. 139—140.
20. Шаповалов В.В., Ужик В.В., Шаповалова В.О. Вивчення особливостей експертних досліджень і характеристика об'єктів судової хіміко-фармацевтичної експертизи у сфері незаконного обігу сильнодіючих, отруйних і психотропних речовин, наркотичних засобів і прекурсорів // Фармац. журн. —1999. —№4. —С. 16—20.
21. Шаповалова В.О., Шаповалов В.В. Питання нормативного тлумачення і класифікації лікарських засобів як складової частини у галузі правового регулювання обігу сильнодіючих, отруйних і психотропних речовин, наркотичних засобів і прекурсорів в Україні // Фармакол. Вісник. —1998. —№4. —С. 19—24.
22. Халин Н.М., Шаповалов В.В., Шаповалова В.А. и др. Правовая и судебная фармация как базовая основа в изучении аспектов расследования преступлений, связанных с наркобизнесом и другими преступлениями в области медицины и фармации // В сб.: Дослідження сучасної фармації та перспективи розвитку у новому тисячолітті. —Харків, 1999. —С. 767.
23. Шаповалова В.А., Даниленко В.С., Шаповалов В.В., Бухтиарова Т.А. Лекарственные средства, отпускаемые без рецепта врача / Под ред. В.А. Шаповаловой, В.С. Даниленко. —Харьков: Торсинг, 1988. —528 с.
24. Шаповалов В.В. Розробка науково-практичних основ в організації та проведенні судової хіміко-фармацевтичної експертизи лікарськіх засобів. Автореф. дис. … канд. фарм. наук. —Харків, 1997. —25 с.
25. Шаповалов В.В., Шаповалова В.А., Ужик В.В. Сільнодіючі, отруйні, психотропні речовини, наркотичні засоби та прекурсори як об'єкти дослiдження судової хіміко-фармацевтичної експертизи на попередньому слідстві / В сб.: Актуальні проблеми післядипломної медичної та фармацевтичної освіти в Україні. —Харків: "Око", 1998. —С. 197—199.
26. Shapovalova V., Shapovalov V., Mykhailov V., Chayka L.. Remedia "Zdorovye Narodu" / Kharkov: Rider, 1999. —200 c.
27. Britich pharmacopopeia. —London, 2000. —V. I-II. —2166 p.
28. The United States pharmacopopeia 23, Kway, Rockville. —MD. —1995. —2391 p.