МЕХАНІЗМИ ІНТОКСИКАЦІЙ
УДК 615.8; 612.014.014.46:547.6+547.8:615.211.099.08
Н.А. Мохорт, д.м.н., Л.М. Киричок, к.б.н., Н.Н. Серединская, к.м.н.
ТОКСИКОДИНАМИКА МОРФОЛИДА ПЕЛАРГОНОВОЙ КИСЛОТЫ
Институт фармакологии и токсикологии АМН Украины, г. Киев
Вещества, оказывающие в минимальных концентрациях выраженное раздражающее действие на чувствительные нервные окончания роговицы глаз, слизистой оболочки верхних дыхательных путей, кожных покровов и вызывающие кратковременные, длящиеся немногим дольше периода воздействия, потери дееспособности пораженных, привлекают пристальное внимание специалистов-токсикологов [1—7]. По токсикологической классификации такая группа веществ относится к временно выводящим из строя. Действительно, ноцицептивное действие их проявляется практически без латентного периода, сравнительно непродолжительное время, как правило отсутствует период последействия. Фармакологические характеристики таких веществ позволяют рассматривать их в качестве одного из видов средств самообороны, обеспечения общественного порядка и пресечения противоправных действий нарушителей.
К раздражающим относятся многие вещества разной химической структуры, однако наиболее известными и используемыми являются о-хлорбензилиденмалонодинитрил (СS), дибенз (b, f)-1,4-оксазепин (CR), хлорацетофенон (CN), трихлорнитрометан, дифенилхлорарсин, дифенилцианарсин, хлорфенарсазин и др., а также природные раздражающие вещества и их синтетические аналоги: капсаицин, 1-метокси-1,3,5-циклогептатриен, производные морфолида алифатических карбоновых кислот и др. [8—20].
Специфическое раздражающе-болевое действие ирритантов опосредовано взаимодействием с тканевыми ферментными системами нервных окончаний. Раздражающее действие, как правило, не приводит к патоморфологическим изменениям клеточных ультраструктур, однако эти вещества вступают в реакции с белковыми компонентами мембран, содержащими сульфгидрильные группы и регулирующими функционирование ионных каналов. При этом в результате возбуждения ноцицепторов слизистых оболочек и кожи при воздействии ирритантов формируется афферентная импульсация, которая по восходящим нервным волокнам активирует системы спинного и головного мозга, создавая ощущения жгучей боли. Все остальные компоненты болевой реакции, в том числе вегетативные, поведенческие, эмоциональные, формируются на основе и в зависимости от силы и длительности перцептуального компонента.
Наиболее известным ирритантом производных морфолида алифатических кислот является морфолид пеларгоновой кислоты (МПК). МПК, широко используемый в последние годы в качестве активного ингредиента для оснащения специальных изделий, обеспечивающих быстрое и удобное воздействие на объекты, оказывающие противоправное действие.
Морфолид пеларгоновой кислоты:
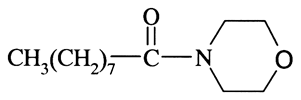
Это маслянистая прозрачная жидкость с желтоватым оттенком, молекулярная масса 227,31, температура кипения 310—315°С, летучесть при температуре 20°С — 27 мг/м3, при 35°С — 43 мг/м3, не растворима в воде, растворима в полярных органических растворителях (ацетоне, пропаноле, диметилформамиде, бензоле, спиртах), жирах (подсолнечное, касторовое масла и др.); устойчиво к гидролизу, окислению, фотодеструкции. При разложении образуется пеларгоновая кислота и морфолид.
Широкая распространенность специзделий в виде газовых баллонов, патронов, гранат, оснащенных морфолидом пеларгоновой кислоты, с одной стороны, и недостаточная научная обоснованность его безвредного использования, в частности, практическое отсутствие информации по острой и подострой токсичности при разных путях поступления в организм, влиянии этого ксенобиотика на функционирование органов и систем в условиях одного и многократного ингаляционного воздействия, сведений о кумулятивных, аллергизирующих, эмбриотоксических, тератогенных, гонадотоксических, цитотоксических свойствах, с другой стороны, и явились основанием для проведения наших исследований.
С учетом возможной видовой и половой чувствительности к действию пеларгоновой кислоты эксперименты выполнены на здоровых половозрелых лабораторных животных: белых мышах, крысах, морских свинках, кроликах и собаках.
Острую токсичность определяли при пероральном и накожном путях поступления в организм, а для белых крыс — и при ингаляционном воздействии.
В качестве показателя степени острой токсичности морфолида пеларгоновой кислоты использовали среднесмертельную дозу (ЛД50, мг/кг), которую определяли по методам В.Б. Прозоровского и соавт., Ван дер Верну.
Ингаляционную динамическую затравку проводили в боксах 9БП-ОС. Подачу вещества в бокс осуществляли через форсунку с помощью ингалятора ПАИ-2 со скоростью поступления воздуха 12 л/мин, концентрация рабочего раствора ирританта — 45 мг/мл. В качестве растворителя использовали изопропиловый спирт, время экспозиции 60 мин. Наблюдение за животными проводили в течение 14 суток. Полученные данные и представлены в табл. 1.
ЛД50 морфолида пеларгоновой кислоты установлена лишь при введении ксенобиотика внутрь — 1600—2240 мг/кг. При этом дозы до 1260 мг/кг гибели животных не вызывали, а дозы 2000—2500 мг/кг являются абсолютно смертельными.
По степени токсичности (ГОСТ 12.1.007-76) морфолид пеларгоновой кислоты относится к III классу химических соединений — классу малотоксических веществ. Какой-либо половой и видовой чувствительности к соединению не выявлено.
В конце срока наблюдения осуществляли эвтаназию животных, подвергавшихся однократному ингаляционному воздействию морфолида пеларгоновой кислоты в токсодозах 10000 мг•мин/л. Патоморфологическому изучению подвергали органы дыхания.
Визуально роговица и конъюнктива глаз и век, трахея и легкие не изменены. Микроскопически на обзорных гематоксилин-эозиновых препаратах* роговицы, трахеи, бронхов и легкого некробиотических изменений не выявлено. В роговице глаз и конъюнктиве не обнаружено дистрофических изменений. Вместе с тем на внутренней поверхности века отмечается утолщение многослойного эпителия, отдельные эпителиоциты были набухшими с просветленными ядрами. Слизистая оболочка трахеи у некоторых животных не изменена и выстлана многоядерным однослойным мерцательным эпителием. У других животных такой структурной четкости не наблюдалось, поскольку слизистая оболочка и подслизитая трахеи на значительном протяжении были инфильтрированы лимфоцитами и гистиоцитами. Легочная ткань в основном воздушна, однако местами отмечалось полнокровие мелких кровеносных сосудов и межальвеолярных капилляров, встречались небольшие участки альвеолита и эндоваскулита. В некоторых бронхах среднего и мелкого калибра выявлялось набухание покровного эпителия, некоторые клетки подверглись десквамации. Указанные морфологические особенности свидетельствуют, что морфолид пеларгоновой кислоты хотя и не вызывал гибели подопытных животных в дозах 10000 мг• мин/л, однако проявлял выраженное раздражающее действие на органы дыхания, сопровождающееся продуктивной реакцией в трахее, очаговым полнокровием, альвеолитом и эндоваскулитом.
Важным критерием оценки токсического действия ксенобиотиков является их способность оказывать летальный эффект при повторных введениях даже в незначительных дозах, то есть способность кумулироваться в организме. Накопление в организме ксенобиотиков (материальная кумуляция) зависит от различных факторов, прежде всего от физико-химических свойств вещества, режима его введения и др. Повторное введение высоких доз веществ, даже быстро выводящихся из организма, может привести к явлениям кумуляции. Поэтому к изучению явлений кумуляции следует подходить весьма осторожно, так как во всех случаях, когда скорость поступления ксенобиотика в организм в течение более или менее длительного времени остается выше скорости удаления его из организма, кумулятивный эффект, как правило, проявляется. При функциональной кумуляции после каждого введения ксенобиотика в организм сохраняется следовая реакция, а суммация этих следовых реакций и вызывает токсический эффект. Вышесказанное предопределило необходимость проведения исследований по выяснению возможной кумуляции морфолида пеларгоновой кислоты в организме.
Следуя рекомендациям (Лимм, И.М. Трахтенберг и др.), исследования выполнены на мелких лабораторных животных в условиях постоянного возрастания ежесуточно водимого количества ксенобиотиков. При этом были использованы белые мыши и белые крысы, причем учет реакции самок и самцов проводили раздельно. Препарат вводили перорально в виде 50% раствора в подсолнечном масле. Начальная доза препарата составляла 10% от ЛД50, определенной при однократном пероральном введении. Для мышей и крыс эти дозы составляли 160 мг/кг и 224 мг/кг, соответственно. Через каждые 4 последующих дня дозы морфолида пеларгоновой кислоты увеличивали на 5%. К концу опыта (24 сут) доза ирританта составляла 35% от ЛД50. В ходе эксперимента фиксировали сроки гибели и рассчитывали суммарную дозу, вызвавшую гибель животных. Полученные данные представлены в табл. 2.
Согласно полученным данным, коэффициент кумуляции К (О.Н. Елизарова) составляет для белых мышей 3,98±4,04, а для крыс -7,5±6,2. Эти данные позволяют сделать заключение об отсутствии материальной кумуляции морфолида пеларгоновой кислоты у животных разных полов. Изучение влияния МПК на функциональное состояние жизненно важных органов и систем проведено также и в условиях многократного ингаляционного воздействия.
Опыты выполнены на 50 половозрелых белых крысах массой 180—210 г. регистрировали массу и температуру тела, морфологический состав периферической крови, состояние выделительной системы, дыхания, сердечно-сосудистой системы, печени, легочно-весовые коэффициенты, а также проводили патоморфологическое исследование внутренних органов. Концентрацию морфолида пеларгоновой кислоты, наряду со спектрофотометрическим методом, определяли и расчетным путем по формуле Габера:
C1 = Д х М х Т / V x P (мг•мин),
где: С — концентрация ирританта в мг•мин/л;
t — экспозиция в минутах;
М — расход диспергируемого раствора (мл/мин);
Д — разведение раствора (мг/мл);
Р — кратность объема аэрозоля в камере в течение 1 минуты;
У — объем камеры (л).
Полученные данные представлены в табл. 3.
Установлено, что концентрация морфолида пеларгоновой кислоты в процессе ингаляционных затравок и по данным спектрофотометрического метода анализа была достаточно стабильной и составляла 2,86±0,19 мг/л, а суммарная токсодоза за весь период затравки составляла 27 мг•мин/л. Гибели животных в течение затравки не наблюдалось. Однако к концу наблюдения (28 сут) погибло 3 крысы, (6,0% от общего количества животных в группе).
Существенного изменения массы тела подопытных животных, температуры тела не выявлено. Показатели состояния сердечно-сосудистой и дыхательной систем, оцениваемые в динамике (по частоте сердечных сокращений, вольтажу и продолжительности зубцов RR, R по ритмичности, глубине, частоте дыхания), под влиянием многократного ингаляционного воздействия морфолида пеларгоновой кислоты претерпевали некоторые изменения: в первые дни наблюдения частота дыхания несколько увеличилась, однако глубина его снижалась. В этот период урежалась и частота сердечных сокращений, статистически значимо снижался вольтаж зубца R; в последующие сроки наблюдения каких-либо закономерных изменений показателей не отмечалось.
Ингаляционное воздействие МПК в условиях динамической затравки в закрытой камере приводит к кратковременному нарушению азотного обмена, величина суточного диуреза, истинная реакция мочи при этом изменяются.
О функциональном состоянии печени судили по активности аланин- и аспартатаминотрансфераз — ферментов, катализирующих межмолекулярный перенос аминогрупп между амино- и кетокислотами. Установлено (табл. 3), что в период затравки изменяется соотношение и существенно падает активность ферментов, заметно снижается детоксицирующая функция печени.
Наиболее уязвимым органом в условиях ингаляционной затравки МПК являются легкие животных. Так, уже после третьей затравки отношение массы сухой ткани легкого к влажному достоверно увеличивается, причем такое состояние сохраняется и после прекращения затравок.
Закономерных изменений со стороны морфологического состава периферической крови, свертывающей системы крови, весовых коэффициентов внутренних олрганов (сердца, почек, печени, надпочечников, селезенки) не выявлено.
На вскрытии животных, независимо от срока наблюдения, визуально во всех исследуемых органах патологических изменений не выявлено. При микроскопическом исследовании обзорных препаратов роговицы глаза, конъюнктивы, века, трахеи, легких на 3 сут также изменений не выявлено. Трахея имеет обычное строение, слизистая оболочка выстлана многорядным однослойным мерцательным цилиндрическим эпителием, собственно оболочка представлена рыхлой волокнистой соединительной тканью, в слизистой и подслизистой трахеи некробиотических и дистрофических изменений не установлено, продуктивная реакция отсутствует. Легочная ткань воздушна, альвеолярные перегородки обычной конфигурации, однако в легких у ряда животных обнаруживались очаговые гемодинамические расстройства, которые сопровождались расширением и полнокровием межальвеолярных капилляров, местами нарушалась проницаемость сосудов и форменные элементы крови проникали в просвет альвеол. Обнаруживались небольшие очажки альвеолита и эндоваскулита. Эпителий бронхов набухший, местами слущен.
К 10—14 сут наблюдения деструктивных изменений роговицы глаза, конъюнктивы, трахеи не выявлено. Циркуляторные расстройства ослабевали, однако продуктивная реакция в легких усиливалась. Многие альвеолярные перегородки утолщались за счет инфильтрации их мононуклеарами, в полости некоторых альвеол обнаруживались свободные клетки. Изредка вокруг кровеносных сосудов располагалось небольшое количество лейкоцитов. Покровный эпителий бронхов набухший, ядра увеличены в размерах, отмечалась десквамация эпителия в просвет бронхов.
В последующие периоды наблюдения продуктивная реакция уменьшалась, однако иногда встречались небольшие очажки альвеолита и эндоваскулита, в полостях альвеол увеличивалось количество альвеолярных макрофагов и свободных клеток.
По собственным и литературным данным, морфолид пеларгоновой кислоты не обладает аллергизирующими, эмбриотоксическими, тератогенными, гонадотоксическими свойствами: ксенобиотик не индуцирует аберрации хромосом в клетках костного мозга мышей in vivo, однако проявляет слабую цитогенетическую активность в тесте на индукцию аберрации хромосом в культуре лимфоцитов периферической крови человека in vitro без метаболической активации, то есть МПК может быть отнесен к ІІІ классу веществ по потенциальной мутагенной опасности (слабые мутагены).
Таким образом, морфолид пеларгоновой кислоты является малотоксичным веществом, не кумулируется в организме, при продолжительном введении не вызывает деструктивных стабильных повреждений органов и систем, не представляет опасности как промышленный аллерген, не оказывает эмбриотоксического и тератогенного эффекта.
Все вышесказанное позволяет считать возможным использование морфолида пеларгоновой кислоты в качестве активного ингредиента в специзделиях (аэрозольные баллоны, патроны для газовых пистолетов, гранаты) и др.
__________________________
* — патоморфологические исследования выполнены при участии
Литература
1. Азбукин Г.В. К вопросу о патогенезе действия раздражающих веществ // Воен.-медиц. журн. —1982. —№11. —С. 52.
2. Anderson P.J., Lau G.S.N., Taylor W.R.J. et al. Acute effect of the potent lacrimator O-chlorobenzylidene malononitrile (CS) tear gas // Hum. and Exp. Toxicol. —1996. —V. 15, №6. —P. 461—465.
3. Barr Stepnen J. Chemical warfare agents // Top. Emergency Med. —1985. —V. 7, №1. —P. 62—70.
4. Foster R.W., Weston Kathleel M. Chemical irritant algesia assessed using the human blister base // Pain. —1986. —V. 25, №2. —P. 269—278.
5. Ballantyne B., Gall D., Robson D.C. Effects on man of drenching with dilute solutions of O-chlorobenzylidene malononitrile (CS) and dibuz(b,f)-11,4-oxazepine (CR) // Medicine, Science and Law. —1976. —V. 16, №3. —P. 159—170.
6. Balfaur D. Studies on the uptake and metabolism of dibenz(B,F)-1,4-oxazepine (CR) by guinea pig cornea // Toxicology. —1978. —V. 9, №1-2. —P. 11—20.
7. Ballantyne B. evaluation of ophthalmic hazards from an aerosol generator of O-chlorobenzylidene malononitrile (CS) // Military medicine. —1979. —V. 144, №10. —P. 691—694.
8. Мохорт Н.А. Капсаицин —физиологически активное вещество // Экспериментальная и клиническая фармакология. —1993. —Т.56, №1. —С. 67—69.
9. Dokkyo J. Capsaicin induces eosinophil infiltration into the guinea pig conjunctiva via the release of endogenous substance P/Kawata Ei-ichirou // Dokkyo J. Med. Sci. —1995. —V. 22, №4. —P. 195—202.
10. Elskamp D.M.W. Toxic properties of CN and CS (Toxische elgen schappen van CN en CS) // Sci. Tech. Aerosp. Rep. —1977. —№15. —P. 12.
11. Amann R., Lembeck F. Capsaicin-induced desensitization of primary afferents in rat and rabbit // Eur. J. Pharmacol. —1990. —V. 183, №5. —P. 1675.
12. Collier J.G., Fuller R.W. The effect of inhaled capsaicin in man // J. Physiol. —1982. —V. 33, №2. —Р. 37—38.
13. Maxwell D.L., Fuller R.W., Dixon C.M.S. Ventilatory Effects of Inhaled Capsaicin in Man // Eur. J. Clin. Pharmacol. —1987. —V. 31, №6. —Р. 715—717.
14. Хрусталева Ю.В. Судебно-медицинская характеристика поражений, причиняемых из средства самообороны в аэрозольной упаковке "Черемуха CN". —Автореф. дис. … канд. мед. наук. —Санкт-Петербург, 1998. —21 с.
15. Бандман А.Л., Саватеев Н.В. Токсикология CR // Военно-медицинский журнал. —1977. —№3. —С. 84—86.
16. Бандман А.Л., Мильштейн Г.И. Токсикология СS // Военно-медицинский журнал. —1974. —№11. —С. 85—87.
17. Исследование полицейского вещества CR в США // РЖ "Военная техника и экономика". —1975. —№2. —С. 11.
18. Bruch J. Die Ultrastruktur der Lungen-Veranderungen nach Inhalation von Reizgasen // Prax. Pneumol. —1975. —V. 29, №9. —Р. 512—517.
19. Colgrave H.F., Mares T.C. Long-term effects of single inhaled doses of 2-chlorobenzylidene malononitrile (CS) // Brit. J. Pharmacol. —1983. —V. 80. —P. 495.
20. Муковский Л.А., Шумакова К.М., Куглеев А.А. и др. Антидотная терапия при поражении глаз газовым оружием // Токсикол. вестн. —1996. —№5. —С. 26—28.